DS-8201新增胃癌适应症:疾病控制率为86%!
2024-08-23 15:44:27
来源:
搜狐科技
8月5日,国家药品监督管理局(NMPA)批准抗体偶联药物(ADC)优赫得(德曲妥珠单抗,DS-8201,Enhertu,T-Dxd)用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。这是DS-8201在国内获得的第三个适应症。

截图来源于NMPA
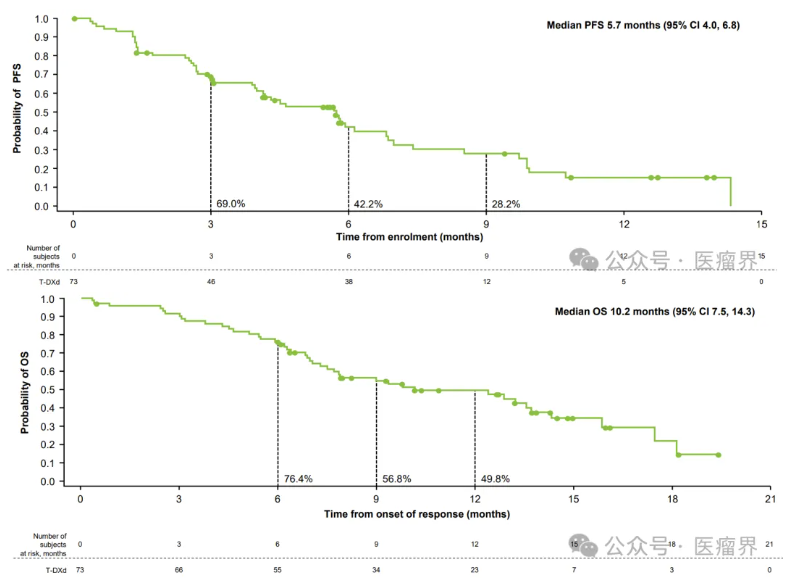
 截图来源于参考资料1,侵权请联系删除
截图来源于参考资料1,侵权请联系删除
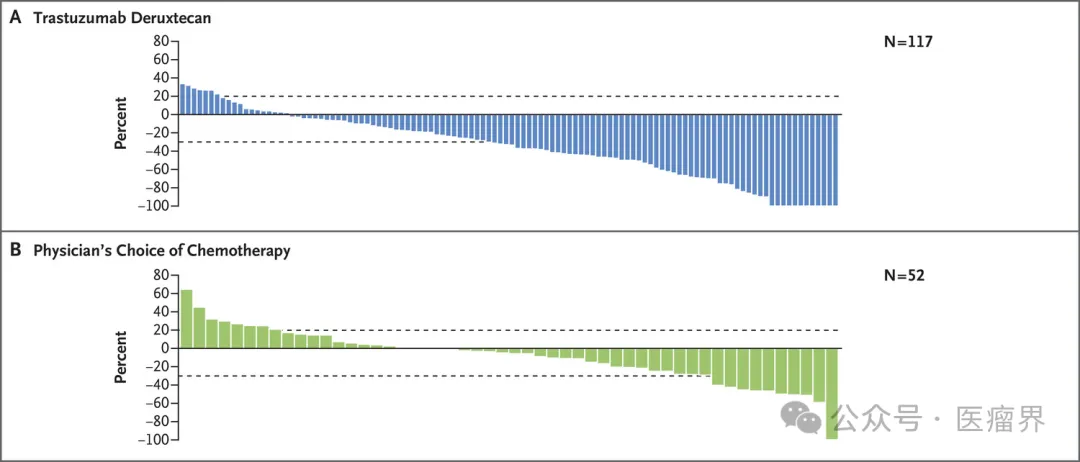
截图来源于参考资料2,侵权请联系删除
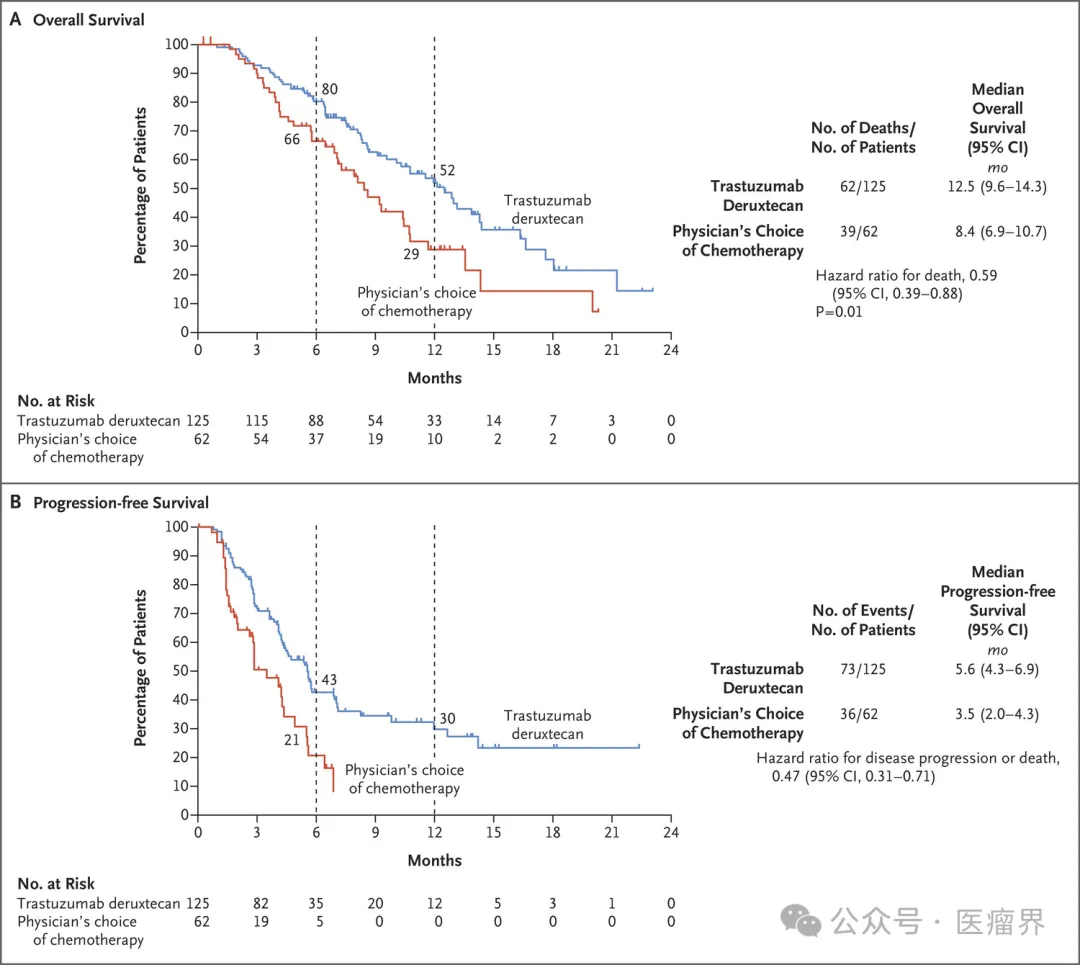
截图来源于参考资料2,侵权请联系删除
目前DS-8201正在正在全国范围内寻找HER2 过表达的实体瘤患者,患者可通过参加临床试验来接受药物治疗,病历资料审核通过后可免费入组接受治疗。如果有需要或有兴趣了解临床试验的患者可以联系医瘤界医学部(400-880-3716)。临床试验对于传统疗法无效或疗效较差的患者来说,可能带来新的希望和治疗机会,并能大大减轻家庭经济负担。对临床试验有兴趣或需要帮助的患者可致电至医瘤界医学部(400-880-3716)来寻找适合的临床研究。


声明:该文观点仅代表作者本人,我们只提供信息存储空间服务。